洪斌/武临专课题组Angew文章:细胞色素P450催化创新霉素生物合成中C-S键的形成
来源:科研处
作者:洪斌
时间:2021-05-25
浏览次数:
Angewandte Chemie International Edition 2021年4月21日在线发表了我所洪斌/武临专课题组的研究论文“The cytochrome P450 catalyzing C‐S bond formation in S‐heterocyclization of chuangxinmycin biosynthesis”。
细胞色素P450酶在微生物和植物来源的天然产物生物合成中扮演了重要角色,可以催化天然产物结构骨架形成和修饰过程中C-O、C-N、C-C和C-S等化学键的形成。然而,到目前为止尚无P450催化微生物次级代谢产物中C-S键形成的酶学研究报道,人们对此类反应的催化机制知之甚少。

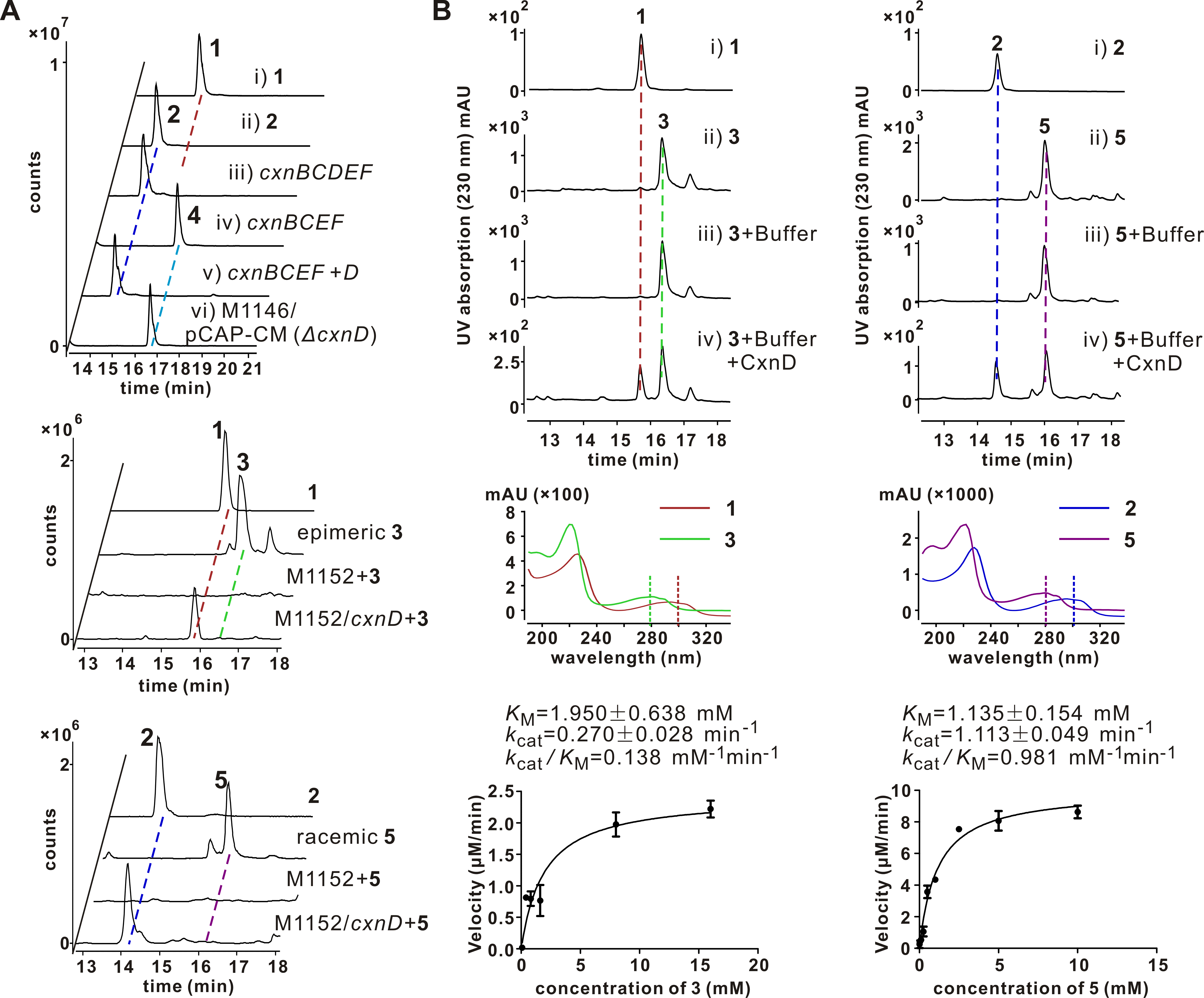
创新霉素(1)是20世纪70年代由我所从济南游动放线菌中发现的一个具有新颖的吲哚骈二氢噻喃环母核结构的抗生素。2017年,我所洪斌课题组和武临专课题组合作首次定位了创新霉素的生物合成基因簇,根据生物信息学分析以及初步体内基因阻断结果,推测该基因簇中编码P450的cxnD基因负责创新霉素生物合成中噻喃环C-S键的形成。在本研究中,他们构建了去甲创新霉素的异源表达体系(CxnBCDEF),鉴定了CxnBCEF表达菌株产生的中间体(化合物4)的结构,据此推测化合物5是CxnD的底物。通过体内饲喂和体外生化反应,证明化学合成的3或5可以被CxnD催化形成C-S键,产生创新霉素(1)或去甲创新霉素(2),确定5是CxnD的最适底物,并发现CxnD具有底物立体结构选择性。
为研究CxnD催化C-S键形成的分子机制,他们将CxnD/C28S(Cys28可能干扰晶体形成)以及其与化合物2、3和4分别进行结晶,成功获得了CxnD/C28S与4的高质量复合物晶体,经X-衍射和结构解析获得了分辨率为2.0 Å的CxnD三维结构。将2R-5与CxnD晶体结构进行分子对接,显示2R-5在CxnD底物结合腔中的结合模式与4非常相似;2R-5与CxnD存在多种相互作用,这些相互作用将2R-5分子保持在CxnD中的固定位置。
他们对CxnD中参与底物结合和反应的关键氨基酸分别进行点突变,测定这些突变体的底物结合活性和催化活性,发现CxnD螺旋I中的保守苏氨酸(T239)对于催化活性至关重要,这一点与很多已知的P450一致。然而,在CxnD中,与T239相邻的保守酸性氨基酸(E/D)被碱性氨基酸(K238)所替代,将K238突变为E或A时均导致CxnD活性丧失,表明K238是CxnD的一个独特的关键作用位点,它不参与质子传递过程,而是与底物的羧基存在较强的作用力,在CxnD的底物结合方面发挥关键作用。

综合对CxnD的生物化学和结构生物学研究结果,他们提出了CxnD在创新霉素生物合成中催化分子内C(sp2)-H硫醇化、形成吲哚骈噻喃三环骨架的分子机制:在P450(CxnD)催化循环中Compound I形成后,或者从吲哚环的亚氨基上夺取氢原子形成吲哚自由基,或者从吲哚环上夺取一个电子、然后释放一个质子形成吲哚自由基;由于待成键的C原子和S原子相距较远,该自由基中间体经过电子重排与重定位后,Compound II再进一步夺取硫醇上的氢原子形成S自由基或者在吲哚环上继续夺取一个电子形成碳正离子,最终形成C-S键。
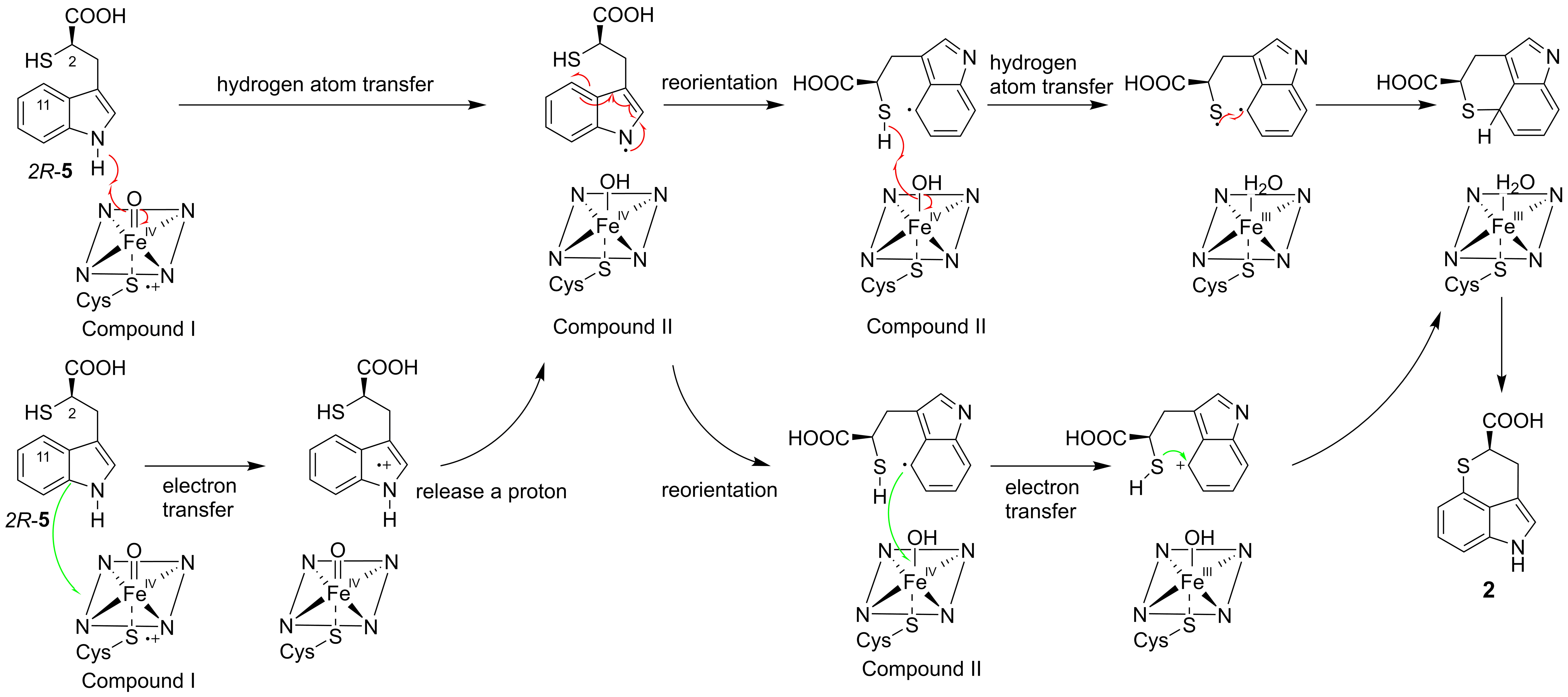
该研究结果拓宽了人们对天然产物生物合成中C-S键形成机制的认识,为理解其他天然产物中C-S键形成,以及获得工程化P450酶奠定了基础。




